 TIRF全内反射荧光显微镜
TIRF全内反射荧光显微镜
 首页 > 解决方案 > TIRF全内反射荧光显微镜
首页 > 解决方案 > TIRF全内反射荧光显微镜

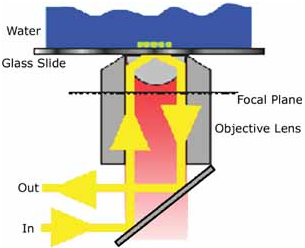
生物单分子研究是指在单分子水平上对生物分子行为(包括构象变化、相互识别、相互作用等)的实时动态检测以及在此基础上的操纵和调控等单分子光学成像技术有宽场相衬显微术、共焦荧光显微术、近场光学扫描显微术和全内反射荧光显微术(TIRFM)。其中,全内反射荧光显微术(TIRFM)是利用全内反射产生的隐失场来照明样品,在百纳米级厚的光学薄层内的荧光团受到激发,荧光成像的信噪比很高,依靠单光子探测器(EMCCD)用来观察单分子成像,及观测发生在细胞膜上的生理反应。
|
生物单分子研究是指在单分子水平上对生物分子行为(包括构象变化、相互识别、相互作用等)的实时动态检测以及在此基础上的操纵和调控等单分子光学成像技术有宽场相衬显微术、共焦荧光显微术、近场光学扫描显微术和全内反射荧光显微术(TIRFM)。其中,全内反射荧光显微术(TIRFM)是利用全内反射产生的隐失场来照明样品,在百纳米级厚的光学薄层内的荧光团受到激发,荧光成像的信噪比很高,依靠单光子探测器(EMCCD)用来观察单分子成像,及观测发生在细胞膜上的生理反应。TIRFM可用于实时观察单个肌浆球蛋白分子的运动、单个蛋白分子对之间的荧光共振能量转移(FRET)、ATP酶的翻转、聚合物内单个分子的结构变化、等离子体膜附近的神经分泌腺的颗粒运动、胞内吞和胞吐等现象。 |
 |
|
|
|
| Alexa633标记的单个NTF2分子穿越细胞核膜的高时间分辨系列图片,AndoriXon EMCCD DV860拍摄。稳定转染了GFP-POM121蛋白的HeLa细胞图像从绿色通道获取,这个图像叠加在显示单个NTF2-Alexa633分子和核膜结合(这是核-细胞质转运的第一步)的一套序列图像上。序列图片从红色通道获得,曝光时间为2.5 ms,采集速度为400帧/秒,采集视野为18.5x18.5 μm2,图像在和绿色通道叠加前通过一个3x3x3 Gaussian函数滤镜,背景消减和gamma调节(1.5)。 (图片由德国理论物理和化学研究所的Ulrich Kubitscheck,教授提供) |
|
 |
|
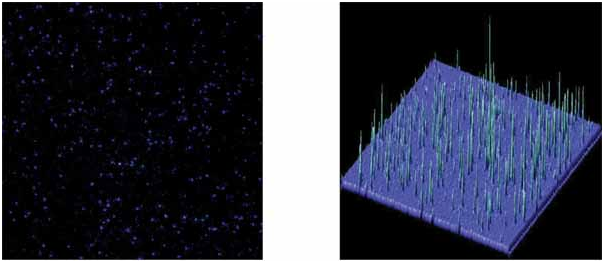
| 单个CY3分子被固定在玻璃表面,用物镜型TIRFM观察方式,使用DU897 EMCCD获取图象,曝光30ms。 | |
| 单个蛋白分子的运动 | |
|
|
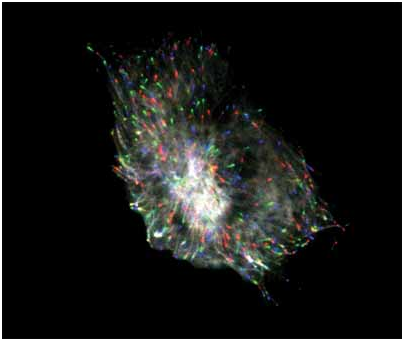
一个细胞的多标图片。细胞核(蓝色标记),肌动蛋白(红色标记)由宽场荧光显微镜拍摄;脂筏簇(绿色标 记)使用TIRFM拍摄图片由耶鲁大学医学院Derek Toomre博士提供。 |
细胞骨架的动态装配 |
|
|
三种颜色标示的微管蛋白(EB1-GFP)的重叠图片,使用物镜型TIRFM(60x 1.45NA)配合iXon DV887背照EMCCD以0.5帧/秒拍摄。不同颜色揭示了微管随时间的运动:第一帧=红色;第十帧=绿色;第二十帧 =蓝色图片由耶鲁大学医学院Derek Toomre博士提供。 |
 |
单分子的FRET实验 |
|
|
荧光共振能量转移(FRET)是指两个荧光发色基团在足够靠近时,当供体分子吸收一定频率的光子后被激发到更高的电子能态,在该电子回到基态前,通过偶极子相互作用,实现了能量向邻近的受体分子转移 |
|
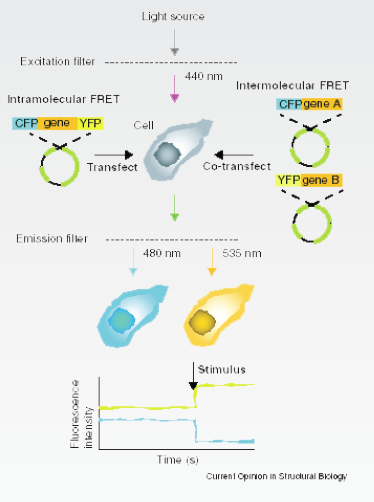 |
FRET显微成像示例: 用供体的激发光激发 样品,在供体和受体 的发射波长上分别记录荧光强度,一旦CFP融合蛋白和YFP 融合蛋白之间发生相互作用或者分子的构象发生变化,分子两端的GFP与YFP靠的足够近,供体的发射光会减弱,而受体的发射光增强 |
| 右图为单个RNA分子的FRET实验,受体和供体(供体发射光为绿色、受体发射光为红色)分别标记在一个内含子的两端,这个内含子折叠剪切出外显子时需要镁离子和一个蛋白辅助因子(CBP2)。左图由于受体和供体没有发生折叠靠近所以几乎没有FRET发生。右图由于镁离子和CBP2的存在,RNA剪切被激活,内含子的两端折叠将两个外显子拉近,这时受体和供体靠的很近因此激发供体则受体发出红色发射光(发生了FRET)。(哈佛大学化学与化学生物系庄晓薇实验室供图) |  |
Copyright © 2008 ColdSpring Science Corporation. 冷泉科技有限公司 京ICP备05055950