 定制自由空间PALM/STORM系统
定制自由空间PALM/STORM系统
 首页 > 解决方案 > 特殊显微镜系统 > 定制自由空间PALM/STORM系统
首页 > 解决方案 > 特殊显微镜系统 > 定制自由空间PALM/STORM系统

光学显微镜的分辨率受衍射现象的限制,阻碍了对活细胞内部结构的观察,长期以来利用最好的光学工具能直接观察清楚的结构大约为200nm,然而参与重要的生命过程的细胞器大多小于200nm。比如突触囊泡,受体蛋白复合物和细胞骨架的组装单元等都为50nm左右,对它们结构和功能的理解需要更高分辨率的光学成像技术。近几年超高分辨率成像技术得到快速发展,其中分辨率最高、最具应用前景的是光敏定位显微成像系统(PALM)和随机光学重构显微成像系统((d)STORM),其分辨率可达20nm. 这种分辨率意味着现在可以在分子水平上观察细胞结构及纳米尺度研究分子运动过程,可观察亚细胞结构精细的组装过程和生物分子共定位分析。
| 突破光学极限 | |
|
光学显微镜的分辨率受衍射现象的限制,阻碍了对活细胞内部结构的观察,长期以来利用最好的光学工具能直接观察清楚的结构大约为200nm,然而参与重要的生命过程的细胞器大多小于200nm。比如突触囊泡,受体蛋白复合物和细胞骨架的组装单元等都为50nm左右,对它们结构和功能的理解需要更高分辨率的光学成像技术。近几年超高分辨率成像技术得到快速发展,其中分辨率最高、最具应用前景的是光敏定位显微成像系统(PALM)和随机光学重构显微成像系统((d)STORM),其分辨率可达20nm。这种分辨率意味着现在可以在分子水平上观察细胞结构及在纳米尺度研究分子的运动过程,可以观察亚细胞结构精细的组装过程和生物分子共定位分析。光敏定位显微成像系统具有单分子探测能力,使得在分子水平研究蛋白质相互作用和蛋白复合物的构象成为可能。(d)STORM与PALM的原理相同,其区别是标记方法不同。 PALM利用光激活荧光蛋白(PAFP)标记目的蛋白分子,而STORM则是利用可反复激活的荧光探针对样品进行标记2006年以来,Science/Nature Methods/PNAS 等高水平杂志发表了数十篇利用这两种技术取得的研究成果,Nature Methods 杂志把高分辨率显微镜技术评为"method of the year 2008"。 |
|
PALM和(d)STORM原理介绍 |
|
| 传统显微镜成像时相邻分子的图像会叠加在一起,所成图像无法分辨细节。PALM和(d)STORM成像时,每次只有少量荧光分子能发出荧光成像。这些荧光分子都处于不断激活和灭活的交替状态。因而发出荧光的分子分散得较为稀疏,相邻分子之间不会受到影响,避免了无法分辨的问题.将这些原始图像进行分析处理,最终得到高分辨率图像。 | 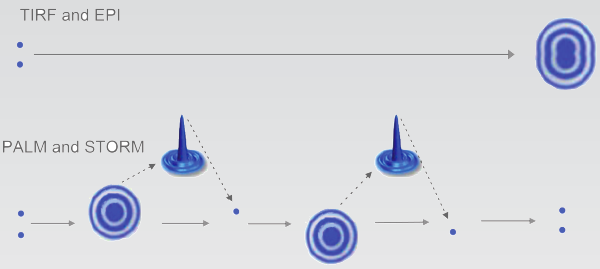 |
TIRFM和PALM比较: |
|
| 样品为COS-7细胞的薄切片,表达了光激活荧光蛋白 Kaede标记的跨溶酶体膜蛋白CD63.在样品切向与溶酶体膜正交的区域,定位精度较高的分子都定位在宽度为10nm的范围内 (A)TIRFM的结果 (B) 相同区域的PALM的结果 (C) B图大方框内区域的放大 (D) B图小方框内区域的放大 |
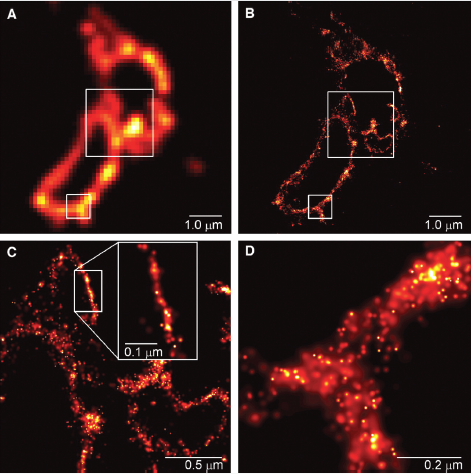 |
| (图片由NIH的Jennifer Lippincott-Schwartz教授和Janelia Farm(HHMI)的Eric Betzig博士提供) SEPTEMBER 2006, SCIENCE VOL 313 | |
TIRFM和STORM比较: |
|
| 样品为免疫荧光技术标记的BS-C-1细胞里的微管.用STROM得到的图像在分辨微管网络细节的能力上有很大的提高,并可以得到微管粗细的统计信息 (A)TIRFM的图像 (B)同一区域的STORM的图像 (C和E)图A中方框区域分别放大的图像 (D和F)图C和E的高分辨率图像 (G)用STORM可以区分相距约80nm的两条微管 (H)通过对图像的分析可以推测微管的直径约为50nm |
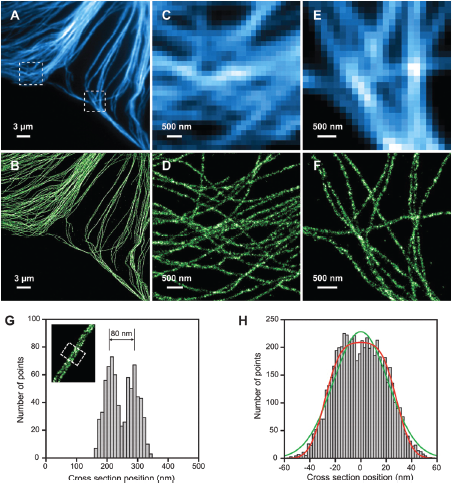 |
| (图片由哈佛大学物理系和化学系教授庄小威提供) SEPTEMBER 2007, SCIENCE, Vol317 | |
神经突出的细胞骨架 |
|
 |
|
|
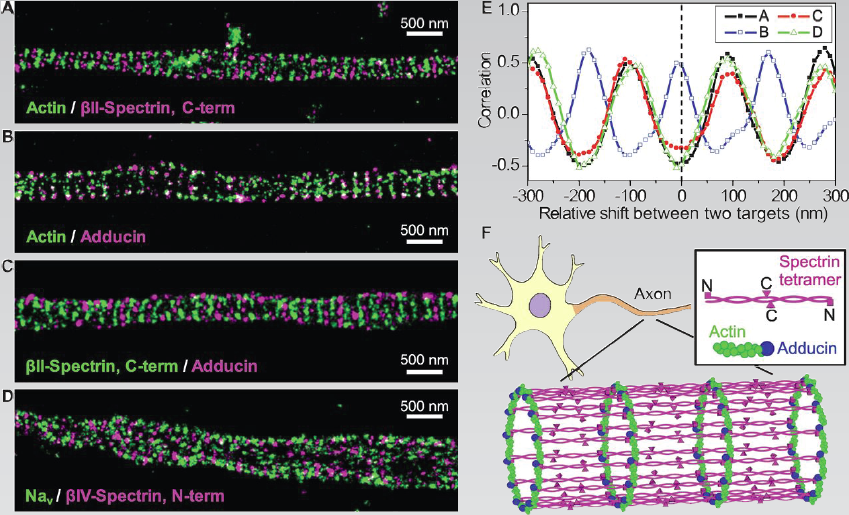
(A-D)STORM图像展示actin,spectrin和adducin在神经轴突中的分布及结构E图为actin, spectrin, adducin和钠离子通道的空间相关性F图为轴突内皮层细胞骨架模型。actin与adducin的一端相连接形成围绕轴突的环状结构,spectrin四聚体沿着轴突方向连接actin/adducin环状物 |
|
细胞骨架和胞内蛋白 |
|
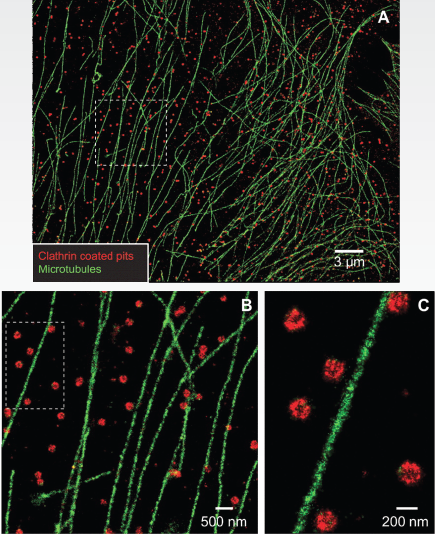 |
|
| 双色STORM :哺乳动物细胞里分别标记microtubules和CCPs的STORM图像。 (A)图是BS-C-1细胞的一大部分区域,microtubules为Cy2 and Alexa 647所标记,CCPs为Cy3 and Alexa 647所标记。它们分别被457nm和532nm的激光激活。 B图、C图分别为A图和B图中方框区域的放大 (图片由哈佛大学物理系和化学系教授庄小威提供) SEPTEMBER 2006, SCIENCE VOL 313 |
|
系统外形图 |
|
|
|
|
|
|
|
Copyright © 2008 ColdSpring Science Corporation. 冷泉科技有限公司 京ICP备05055950